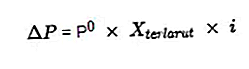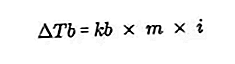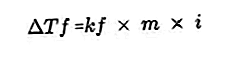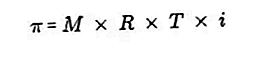Опитайте се да обърнете внимание на това, което е около нас, свързано с химията? Най-лесният е въздухът, който дишаме, който съдържа смес от кислород, азот и други газове. Хранителните подправки, оцветителите и консервантите са също други примери за химикали, които са около нас. Химията е клон на естествените науки, който ще изучавате в училище, който изучава различни материали, един пример е структурата на материята, свойствата на материята, формата на материала, промените в материята, класификацията на материята, подреждането на материята и енергията, която ги придружава промени. Не само математиката и физиката, химията има и различни видове формули, знаете ли. Има много химически формули, от които ще се научите, от колигативни свойства до окислително-възстановителни реакции.
По този повод ще научим различни химични формули, както и примери за техните проблеми, които ще ви помогнат да разберете понятията за химични формули.
Химически формули и примерни проблеми
Наличието на формули в химията е да помогне на изследователите да намерят различни видове експериментални резултати, които да бъдат проведени. За да можете да овладеете добре тази наука, трябва да знаете някои химически формули, които често ще срещате, когато изучавате химия.
Формула за колигативни свойства на решения
Колигативният характер на разтвора е характер на разтвор, който не зависи от вид разтворимо вещество, а зависи само от концентрацията на частиците в разтвора. Тогава колигативните свойства на разтвора се състоят от два вида свойства, а именно, колигативната природа на електролитния разтвор и колигативната природа на неелектролитния разтвор.
- Колигативни свойства на неелектролитни разтвори
Въпреки че колигативната природа включва решение, колигативната природа не зависи от взаимодействието на разтвореното вещество и разтворените молекули, а от количеството разтворено вещество в разтвор. Колигативните свойства се състоят от намаляване на налягането на парите, повишаване на температурата на кипене, намаляване на точката на замръзване и осмотично налягане. Всеки от тях изисква химическа формула, за да получи резултата.
- Уравнение за спада на налягането в парата

Източник: formula.co.id
- Уравнението за увеличаване на температурата на кипене
Точката на кипене на течността е фиксираната температура, при която тя кипи. При тази температура налягането на парите на течността има уравнение за въздушното налягане около себе си и се причинява от изпаряването на всички части на течността. Точката на кипене на течността може да бъде измерена чрез налягане от 1 атмосфера.
Разликата в точката на кипене на разтвора и точката на кипене на чист разтворител се нарича увеличаване на температурата на кипене, уравнението за увеличаване на температурата на кипене е:

Източник: formula.co.id
- Уравнение за падане на точката на замръзване
Разтвореното вещество в разтвора ще направи точката на замръзване на разтвора по-малка от точката на замръзване на разтворителя. Уравнение за намаляване на точката на замръзване:

Източник: formula.co.id
- Осмотичното налягане
Осмотичното налягане е сила, необходима за балансиране на налягането на разтворителя от полупропускливата мембрана през разтвора.
Полупропускливата мембрана е мембрана, през която молекулите на разтворителя могат да преминат, но разтворените вещества не могат да преминат. Според Van't Hoff при осмотичното налягане разтворът се формулира, както следва:

Източник: formula.co.id
- Колигативни свойства на електролитни разтвори
В концентрацията на колигативните свойства на същия електролитен разтвор той има по-голяма стойност, когато го сравним с колигативните свойства на неелектролитния разтвор. Поради големия брой разтворени частици, получени в резултат на йонизационната реакция на електролитния разтвор, който е формулиран във фактора на Van't Hoff.
Изчисляването на колигативните свойства на електролитен разтвор винаги ще се умножава по фактора на Van't Hoff, както следва:

Източник: formula.co.id
Някои от формулите за колигативните свойства на други електролитни разтвори са:
- Спад в налягането на парите
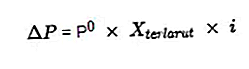
Източник: formula.co.id
- Точка на кипене се увеличава
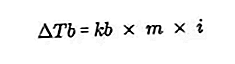
Източник: formula.co.id
- Падане на точката на замръзване
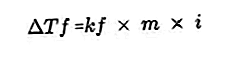
Източник: formula.co.id
- Осмотичното налягане
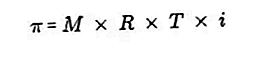
Източник: formula.co.id
Формули за моларност, моларност и молна фракция
Моларност (M)
Моларността е броят на бенките на вещество, разтворено в 1 литър разтвор.

Източник: formula.co.id
М = моларност
Mr = моларна маса на разтвореното вещество (g / mol)
V = обем на разтвора
Молалност (m)
Молалността е броят на моловете на веществото, разтворени в 1 kg разтворител. Химичната формула е следната.

Източник: formula.co.id
m = молалност (mol / kg)
Mr = моларна маса на разтвореното вещество (g / mol)
маса = маса на разтвореното вещество (g)
P = маса на разтворителя (g)
Молна фракция
Молната част е единица за концентрация, при която всички компоненти на разтвора се изчисляват въз основа на молове.

Източник: formula.co.id
xi = брой бенки
i, j, xj = молна фракция
Примери за проблеми с химическата формула
1. Ако осмотичното налягане на 500 ml разтвор на фруктоза, C6H12O6 от 32 ° C е 2 atm, масата на разтворената фруктоза е?
Решение:

2. В молната част на разтвора на карбамид във вода 0,2. Налягането на наситените пари на чиста вода с температура 20 ° C е 17,5 mmHg. Тогава при налягането на наситените пари на разтвора при следната температура е?
хурея + Xвода = 1
0,2 + Xвода = 1
хвода = 0,8
Pрешение = Xвода x P вода
Pрешение = 0,8 x 17,5 mmHg
Pрешение = 14 mmHg
Това са някои химически формули, които можете да научите, за да ви улеснят да отговаряте на различни видове химични въпроси. Ако смятате, че тези формули не са достатъчни, можете да изпробвате продукта PROBLEM, претеглено, пълно, онлайн решение за практикуване на въпроси в Smart Class като тригонометрия, лимит, логаритъм и много други. Започвайки от начални, прогимназиални до гимназиални нива с различни предмети като математика, физика, химия и други. Тук можете да научите различни видове формули, пълни с примерни проблеми.
Хайде какво чакате! Нека опитаме ПРОБЛЕМ упражнения в Smart Class точно сега.