Периодичната таблица е дисплей на химичните елементи, показани в таблична форма. Редът на химичните елементи е подреден въз основа на няколко фактора като атомен номер, електронна конфигурация и химични свойства.
Периодичната таблица се състои от всички химически елементи, които са международно признати, и е разделена на 4 блока, включително блоковете -s, -p, -d и -f. Всеки ред в таблицата се нарича точка, докато колоната се нарича група. По принцип в един период (ред) лявото е метално, а дясното е неметално.
В стандартната периодична таблица елементите са подредени според нарастващия им атомен номер (броят на протоните в атомното ядро). Нов ред (период) започва, когато новата електронна обвивка има първия си електрон. Колона (група) се определя въз основа на електронната конфигурация; елементите, които имат еднакъв брой електрони в дадена подчерупка, са в една и съща колона. Например кислородът и селенът са в една и съща колона, тъй като и двамата имат четири електрона във външната си p-под-черупка.
(Прочетете също: Периодична таблица на химичните елементи, пълна с надписи и изображения)
Елементите с подобни химични свойства обикновено се групират в едни и същи групи в периодичната таблица, въпреки че във f-блока, а някои се намират и в d-блока, елементите от същия период са склонни да имат сходни химични свойства. Следователно е сравнително лесно да се оценят химичните свойства на даден елемент, ако знаете свойствата на елементите около него.
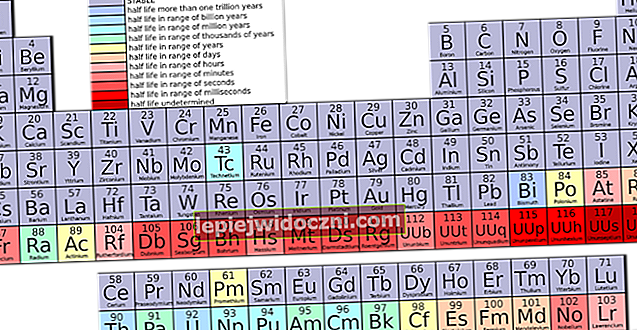
Към 2016 г. в периодичната таблица са потвърдени поне 118 елемента. Те включват елементи 1 (водород) до 118 (оганесон), с неотдавнашни добавки като нихоний, московиум, тенесин и оганесон, потвърдени от Международния съюз за чиста и приложна химия (IUPAC).

Сред всички елементи 94 съществуват естествено; Останалите 24, от америций до копернициум и флеровиум и ливерморий, присъстват само когато се синтезират в лабораторията. От 94-те природни елемента, 84 от тях са първични (древни елементи). Останалите 10 се появяват, когато има разпад на първичните елементи.
Никой елемент, по-тежък от айнщаиния (елемент 99), не се среща в големи количества и в чиста форма. Дори астатин (елемент 85); франций (елемент 87) се открива само под формата на излъчване на светлина в микроскопично количество (300 000 атома).
Групировки на химични елементи
Няколко категории могат да бъдат широко приложени към елементи, включително като се вземат предвид техните общи физични и химични свойства, състоянието на веществото в изобилието от условия, техните точки на топене и кипене, тяхната плътност, тяхната кристална структура като твърдо вещество и техния произход.
Основни характеристики
Въз основа на техните физични и химични свойства, съществуващите елементи са разделени в три категории, а именно метали, металоиди и неметали.
Метал обикновено лъскави, високопроводими твърди вещества, могат да образуват сплави с други метали и да образуват подобни на сол йонни съединения с неметали (различни от благородните газове). Повечето от неметални под формата на безцветен или безцветен газ; неметали, които образуват съединения с други неметали, са ковалентно свързани. Между тях има метали и неметали металоид, който има свойства между метал и неметал или смес от двете.
(Прочетете също: Най-лесният начин да запомните Периодичната таблица, номер 2 е най-готиният)
По-подробна класификация често се посочва от представянето на цветовете в периодичната таблица. Тази система ограничава термините "метал" и "неметал" само до определен брой метали и неметали от голям брой метали и неметали.
По-нататък металите и неметалите могат да бъдат класифицирани в подкатегории, показващи степенуването на свойствата от метал до неметал, за елементите от същия период.
Металите се разделят на реактивни алкални метали, алкалоземни метали, които са по-слабо реактивни, лантаниди и актиноиди, преходни метали и метали след преход с най-слаби физични и химични свойства.
Неметалите се делят на многоатомни неметали, неметали, които са по-подобни на металоидите; двуатомни неметали, основни неметали; и едноатомни благородни газове, които са неметали и почти напълно инертни.
Метал
- 78% от всички известни елементи са метали
- Поставен от лявата страна на периодичната таблица
- Обикновено твърдо при стайна температура
- Обикновено имат високи точки на топене и кипене
- Добър проводник на топлина и електричество
- Може да се изчуква и разтяга
Неметални
- Намира се в горната дясна страна на Периодичната таблица
- Общо има 22 неметала
- Обикновено твърдо вещество или газ със стайна температура
- Ниски точки на топене и кипене
- Лош проводник на топлина и електричество
Металоид
- Показва метални и неметални свойства
Примери: силиций, германий, арсен и антимон
Състоянието на материята
Друго основно нещо, което обикновено се използва за разграничаване на химичните елементи, е състоянието на веществото (фазата), което е твърдо, течно или газово, при стандартна температура и налягане (STP).
Повечето от елементите са твърди при конвенционални температури и атмосферно налягане, докато някои са газове. Само брома и живака са течни при 0 ° C (32 ° F) и нормално атмосферно налягане; Цезият и галият са твърди при тази температура, но се топят при температури съответно 28,4 ° C (83,1 ° F) и 29,8 ° C (85,6 ° F).
Точки на топене и кипене
Точките на топене и кипене, обикновено изразени в градуси по Целзий при налягането на една атмосфера, обикновено се използват за определяне на характера на различни елементи. Тези характеристики за повечето от елементите са известни, но за някои от радиоактивните елементи в много малки количества не са известни. Хелийът остава в течно състояние дори при абсолютна нула при атмосферно налягане, така че Той има само точка на кипене и няма точка на топене в конвенционалното представяне.
Плътност
Плътността при определена стандартна температура и налягане (STP) често се използва при определяне на характера на елементите. Плътността често се изразява в грамове на кубичен сантиметър (g / cm3).
Някои газове, които при измерената температура са газообразни, тяхната плътност обикновено се изразява за тяхното газообразно състояние; когато са втечнени или втвърдени, газообразните елементи имат същата плътност като останалите елементи.
Когато елементът има алотропи с различна плътност, обикновено в заключителното представяне се избира един от представителните алотропи, докато плътността за всеки алотроп може да бъде посочена в раздела за подробности. Например, трите добре познати алотропи на въглерод (аморфен въглерод, графит и диамант) имат плътност от 1,8–2,1; 2,267; и 3,515 g / cm3.
Кристална структура
Елементите, изследвани до момента като твърди проби, имат осем типа кристални структури: кубични, кубични в центъра на тялото, кубични в центъра на лицето, шестоъгълни, моноклинни, орторомбични, ромбоедрични и тетрагонални.
За някои синтетични трансуранови елементи има много малко налични проби за определяне на кристалната структура.
Произходът му е на земята
Въз основа на техния произход е известно, че първите 94 елемента се срещат естествено, докато останалите 24 се получават изкуствено като синтетични продукти чрез изкуствени ядрени реакции.
От 94 естествено срещащи се елемента, 83 се считат за първични и са или стабилни, или слабо радиоактивни. Остатъкът, а именно 11, се нарича ефемерен елемент, тъй като има полуживоти, които са твърде кратки, за да бъдат в началото на Слънчевата система.
От 11 преходни елемента, 5 елемента, като полоний, радон, радий, актиний и протактиний, са продуктите на разпадането на тория и урана. Останалите 6 смъртни елемента, а именно технеций, прометиум, астатин, франций, нептуний и плутоний се произвеждат от рядък процес на ядрена реакция, включващ уран или тежки елементи.